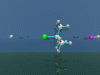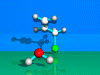This Site is also
available in ENGLISH

Grundreaktionen der Organischen Chemie - Interaktiv
R. Ehrler Kontakt: e-mail rudi@rudolf-ehrler.de
Modellierung Organischer Grundreaktionen mit VRML 2.0-Techniken.
Das Abspielen der VRML 2.0 Dateien erfordert ein VRML PlugIn z.B.
: http://www.parallelgraphics.com
- Jetzt mit Energie Funktion
- Bindungsstärkejetzt
sichtbar: Dunkle Farben kennzeichnen starke Bindungen (Doppel, Dreifach)
- Jetzt voll unter Cortina
VRLM Client lauffähig
- Animation startet bei
Annäherung unter Benutzung von Viewpoints
- Beschleunigtes Laden der
WRL-Files durch Komprimierung
Awards: 



SN1-Reaktion
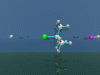
|
Nucleophile Substitution 1. Ordnung.
Beschrieben wird die Substitution des Chloratoms in
t-Butylchlorid miteinem Fluorid-Ion. Die Reaktion wird durch Wasserstoffionen
(Protonen)katalysiert.
Ein Proton nähert sich von links und bildet Chlorwasserstoff. Esbildet
sich ein Trimethylcarbeniumion als Zwischenstufe (planar). Von rechtsnähert
sich Fluorwasserstoff. Unter Abspalten eines Protons bildetsich
t-Butylfluorid.
|
SN2-Reaktion

|
Nucleophile Substitution 2. Ordnung.
Beschrieben wird die Reaktion von Methylchlorid mit einem
Fluorid-Ion.
Das Fluorid-Ion (Nucleophil) nähert sich von rechts und drängt das
Chlorid-Ion aus dem Molekül. Es wird ein Übergangszustanddurchlaufen, wobei
die 3 H-Atome planar angeordnet sind (Zustand höchsterEnergie). Es bildet
sich Methylfluorid.
|
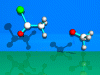
SN2t-Reaktion
|
Nucleophile Substitution 2. Ordnung mit tetragonalem
Übergangszustand.
Beschrieben wird die Reaktion von Acetylchlorid mit einem
Methoxy-Ion.
Das Methoxy-Ion (Nucleophil) addiert sich an die Carbonylgruppe
desAcetylchlorids (tetragonale Zwischenstufe). Das Chlorid-Ion tritt aus,es
bildet sich Essigsäuremethylester.
|
SN2'-Reaktion
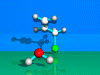
|
Vinyloge Nucleophile Substitution 2. Ordnung .
Beschrieben wird die Hydrolyse von Allylchlorid mit
Wasser.
Ein Wassermolekül (Nucleophil) nähert sich der Vinylgruppein 1-Position
und drängt das Chlorid-Ion (3-Position) aus dem Molekül.Es spaltet sich
Chlorwasserstoff ab. Das Reaktionsprodukt ist
Allylalkohol(Propen-3-ol).
Anmerkung: Die Berechnung der Reaktion wurde idealisiert für die Gasphase
durchgeführt. Solvens-Effekte bleiben dadurch unberücksichtigt.
|
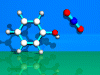
|
Elektrophile Substitution am Aromaten
Beschrieben wird die Nitrierung von Phenol durch ein
NO2-Kation.
Das Kation (linear) nähert sich in o-Position der Phenolgruppeund
verdrängt ein Wasserstoffion. Es wird eine tetragonale
Zwischenstufedurchlaufen. Es entsteht o-Nitrophenol.
|
|
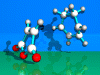
|
Diels-Alder-Reaktion
Pericyclische 4+2 Cycloaddition.
Dargestellt ist die Reaktion von Cyclohexadien mit Maleinsäureanhydridzu
einem bicyclischen System. Die Reaktion verläuft konzertiert.
|
|

|
E1cb-Elimination
Bildung von Styrol.
Dargestellt ist die Reaktion von beta-Chlorethylbenzol mit dem
Methoxid-Anion.Chlorethylbenzol
wird deprotoniert und verliert dann das Chlorid-Ion.
|
|
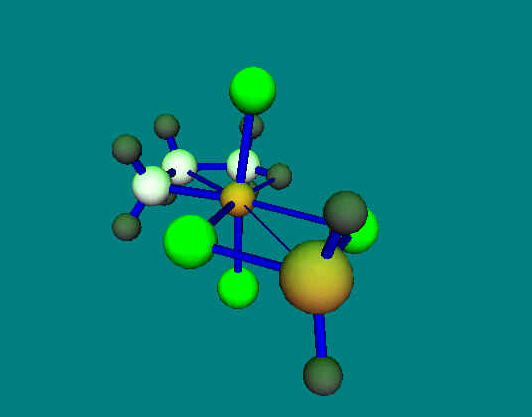
|
Ziegler Katalysator
Addition einer Alkylgruppe (Methyl) an Ethylen am aktiven Zentrum
eines Ziegler-Katalysators [TiCl4 AlH2CH3].
|
Noch mehr? Stereochemische Eigenschaften einfacher organischer Moleküle
Interessante VRML Applikationen in der Chemie von anderen Autoren:
Universität Aberystwyth
Univeristät Bristol
TH Darmstadt
Die Berechnung der Reaktionen wurden idealisiert für die Gasphase durchgeführt.
Solvens-Effekte bleiben dadurch unberücksichtigt.
Interessiert an mehr Informationen?
Kontakt:
rudi@rudolf-ehrler.de
Letzte Aktualisierung: 2005-03-13 von Dr. Ehrler